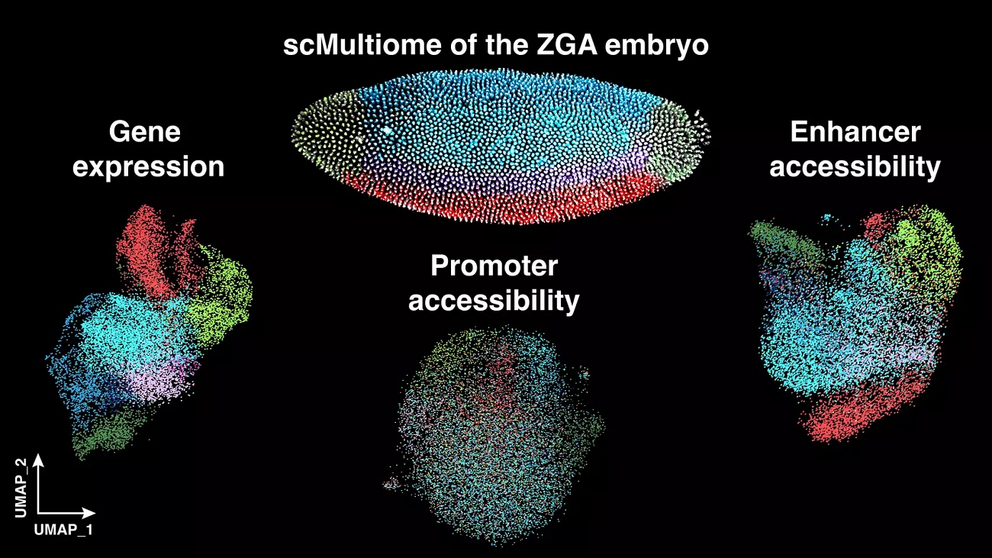
Wir fanden heraus, dass bereits wenige Stunden nach der Befruchtung die Zugänglichkeit des Erbguts an sogenannten Enhancer-Regionen wichtiger ist für die Bestimmung der Zellidentität als die Zugänglichkeit an Promotern,“ erklärt Nicola Iovino. „Wir beobachteten zudem eine bemerkenswerte Koordination verschiedener epigenetischer Mechanismen, die zusammenarbeiten, um falsche Gene auszuschalten und die richtigen Gene zur passenden Zeit zu aktivieren – damit können Zellen ihre spezifischen Funktionen entwickeln.“
Molekulare Dirigenten der frühen Entwicklung
So verhindert die von der Mutter vererbte Histon-Modifikation namens H3K27me3, dass Gene, die nur in bestimmten Zelltypen aktiv werden sollen, in anderen Zellen ungewollt angeschaltet werden. Diese »Schutzfunktion« vermeidet eine Fehlprogrammierung der Zellen in der frühen Embryogenese. Im Gegensatz dazu hat das Protein CBP, das die Histon-Modifikation H3K27ac setzt, die gegenteilige Aufgabe: Es aktiviert transkriptionelle Programme, die dafür sorgen, dass Zellen ihre richtige Identität ausbilden können. “Fehlt die Modifikation, kommt es zum vollständigen Stillstand der Enhancer-Aktivität und der Transkription, wodurch die Zellen in einem undifferenzierten Zustand gefangen bleiben, was gravierende Folgen für die Entwicklung hat,“ so Co-Erstautorin Annamaria Piva aus Mailand.
Ähnlich wie in einem Orchester koordinieren diese Faktoren das Zusammenspiel von Transkriptom und Epigenom: Während H3K27me3 unerwünschte Genaktivierungen verhindert, ist die durch CBP-vermittelte H3K27-Acetylierung unerlässlich, um die Differenzierung von Zellen in Gang zu setzen. „Dieses Gleichgewicht ist entscheidend – wird es gestört, kann der Embryo keine korrekten Zellidentitäten etablieren, was zum Entwicklungsstillstand führt“, erklärt die Mitautorin Yinxiu Zhan vom European Institute of Oncology in Mailand.
Chromatinzugänglichkeit bleibt trotz Transkriptionsstopp bestehen
Eine besonders überraschende Entdeckung war zudem, dass Chromatinzugänglichkeit und Genexpression in der frühen Embryonalentwicklung unabhängig voneinander reguliert werden können. Bisher ging man davon aus, dass offene Chromatinstrukturen automatisch zur Aktivierung von Genen führen. Die Forscher haben jedoch entdeckt, dass sich das Chromatin, also die Verpackung der DNA im Zellkern, auch dann weiter öffnet, wenn das für die Genaktivierung wichtige Protein CBP fehlt. Für das Team um Nicola Iovino deutet das darauf hin, dass es separate Mechanismen für die Chromatinorganisation und die tatsächliche Aktivierung der Gene gibt.
Die Ergebnisse der Studiee unterstreichen die enorme Bedeutung epigenetischer Regulation in der frühen Embryogenese und untermauern die Vorstellung, dass die Weichen für die spätere Gewebebildung sehr früh in der Entwicklung gestellt werden, noch bevor morphologische Veränderungen sichtbar sind. Die Erkenntnisse helfen, grundlegende Prozesse der embryonalen Entwicklung, wie die zygotische Genomaktivierung und die Festlegung der Zellschicksale, besser zu verstehen.
Die Daten der Studie sind interaktiv zugänglich unter: https://iovinolab.shinyapps.io/scmultiomeZGA/
CIBSS Profil von Dr. Nicola Iovino
Originale Pressemitteilung MPI